Teorias Ácidos e Bases
Ao longo do tempo várias teorias ácido-base foram criadas, mas três delas, criadas no século XX, recebem especial atenção nos estudos químicos, que são as teorias de Arrhenius, protônica ou de Brønsted-Lowry e eletrônica ou de Lewis.
Vejamos cada uma delas:
Teoria ácido-base de Arrhenius:
Segundo Arrhenius, uma substância é classificada como ácido ou base de acordo com as espécies iônicas liberadas em solução aquosa.
• Um ácido de Arrhenius é uma substância que produz, exclusivamente, o cátion hidrônio (H3O+ ou H+) quando dissolvido em água.
HCl(aq) + H2O(l) → H3O+(aq) + Cl−(aq)
• Uma base de Arrhenius é uma substância que produz exclusivamente, o ânion hidróxido (OH−) quando dissolvido em água.
NaOH(aq) + H2O(l) → Na+(aq) + OH−(aq)
Teoria ácido-base de Bronsted-Lowry
Os conceitos de ácido e base, em termos de íons hidrônio e hidróxido em água, é muito limitada, porque retringe a discussão do fenômeno ácido-base apenas a soluções aquosas. Uma abordagem mais geral foi proposta, em 1923, pelo químico dinamarques Brönsted e pelo químico britânico Lowry. O conceito de Brönsted-Lowry é mais geral do que o conceito de Arrhenius, porque não nos restringe a soluções aquosas.
Definições
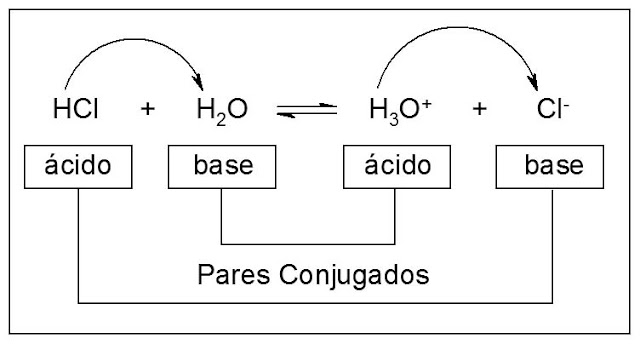
Ácido: é toda a espécie química capaz de doar um próton (íon H+) a uma outra substância.
Base: é definida como uma substância capaz de aceitar um próton (íon H+) de um ácido.
De uma maneira mais simples, ácido é um doador de próton e a base é um receptor de próton.
Na reação acima, o HCl está atuando como ácido, porque está doando um próton para a molécula de água. A água, por outro lado, está se comportando como base, por aceitar o próton do ácido. A reação inversa também é uma reação de Brönsted-Lowry, com o íon hidrônio (H3O+) funcionando como ácido, por doar seu próton, e com o Cl- atuando como base, por aceitá-lo. Ocorre um equilíbrio, onde temos dois ácidos e duas bases, um de cada, em ambos os lados da equação. As espécies que estão relacionadas são denominadas de pares conjugados.

Forças de Ácidos e Bases
A melhor maneira de julgar as forças relativas de ácidos e bases é pela comparação das posições de equilíbrio em várias reações ácido-base. Por exemplo, em água o HCl está, essencialmente, 100% ionizado e o HF somente cerca de 3%. Assim:
Os resultados nos mostram que, em água, o HCl é um ácido muito mais forte do que o HF. Mostram, também, que o F- é uma base muito mais forte do que Cl-, porque nas soluções com o mesmo ácido de referência, H3O+, a maior parte do F- está protonado e existe como HF, enquanto nenhum Cl- está protonado.
Á medida que um ácido se torna mais forte, a sua base conjugada torna-se mais fraca ou á medida que as bases tornam-se mais fortes, os seus ácidos conjugados tornam-se mais fracos.
De forma geral, quando ocorre uma reação ácido-base de Brönsted-Lowry, a posição de equilíbrio situa-se na direção dos ácidos e bases mais fracos.
Lembre-se que quando queremos comparar as forças de ácidos é melhor usarmos uma mesma base como referência.
Teoria ácido-base de Lewis
Definições
Base é toda a espécie química que pode doar um par de elétrons para a formação de uma ligação covalente.
Ácido é toda a espécie química que pode aceitar um par de elétrons para formar uma ligação.
Veja o exemplo abaixo:
O NH3 funciona como base e o BF3 como ácido. Espécies químicas contendo elementos com camadas de valência incompletas, como o BF3 ou AlCl3, tendem a ser ácidos de Lewis, enquanto que espécies químicas ou íons que tenham pares de elétrons não compartilhados podem comportar-se como bases de Lewis.
Reagentes Nucleófilos e Eletrófilos
Uma base de Lewis é uma espécie química que, em suas reações, procura um núcleo com o qual possa compartilhar um par de elétrons. Por isso é denominada nucleófilo (amiga do núcleo). Os ácidos de Lewis procuram espécies que tenham pares de elétrons com os quais possam se ligar, os ácidos de Lewis são denominados eletrófilos (amigo de elétrons).
AlCl3 + COCl2 → COCl+ + AlCl4-