Soluções
As misturas podem ser homogêneas ou heterogêneas.
As misturas homogêneas possuem uma fase distinta.
As misturas heterogêneas possuem duas ou mais fases distintas.
Solução: é uma mistura homogênea entre duas ou mais substâncias. O processo utilizado para obter essa mistura é chamdo de dissolução.
Uma solução é sempre formada pelo soluto e pelo solvente. Solução = soluto + solvente

Soluto – substância que será dissolvida.
Solvente – substância que dissolve.
A água é chamada de solvente universal. Isso porque ela dissolve muitas substâncias e está presente em muitas soluções.
As soluções podem ser formadas por qualquer combinação envolvendo os três estados físicos da matéria: sólido, líquido e gasoso.
Exemplos de soluções no nosso dia-a-dia:
- álcool hidratado
- acetona
- água mineral
- soro fisiológico
Tipos de Dispersão
Dispersão – são sistemas nos quais uma substância está disseminada, sob a forma de pequenas partículas, em uma segunda substância.
Um exemplo é a mistura entre água e areia em um copo. No início, a mistura fica turva, mas com o passar do tempo, as partículas maiores vão de depositando no fundo do copo. Mesmo assim, a água ainda fica turva na parte de cima. A água não ficará totalmente livre de areia.
De acordo com o tamanho das partículas, podemos classificar estas dispersões em solução verdadeira, colóide esuspensão.
Veja a seguir o diâmetro médio das partículas dispersas:
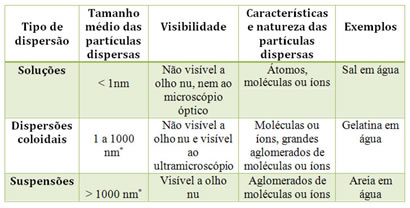
SOLUÇÃO
São misturas homogêneas translúcidas, com diâmetro médio das partículas entre 0 e 1nm.
Exemplos: açúcar na água, sal de cozinha na água, álcool hidratado.
COLÓIDES
São misturas homogêneas que possuem moléculas ou íons gigantes. O diâmetro médio de suas partículas é de 1 a 1.000nm. Este tipo de mistura dispersa facilmente a luz, por isso são opacas, não são translúcidas.
Podem ser sólidas, líquidas ou gasosas.
O termo colóide vem do grego e significa "cola" e foi proposto por Thomas Grahm, em 1860 para as denominar as substâncias como o amido, cola, gelatina e albumina, que se difundiam na água lentamente em comparação com as soluções verdadeiras (água e açúcar, por exemplo).
Apesar dos colóides parecerem homogêneos a olho nu, a nível microscópico são heterogêneos. Isto porque não são estáveis e quase sempre precipitam.
Exemplos: maionese, shampoo, leite de magnésia, neblina, gelatina na água, leite, creme.
Suspensão – são misturas com grandes aglomerados de átomos, íons e moléculas. O tamanho médio das partículas é acima de 1.000nm.
Exemplos: terra suspensa em água, fumaça negra (partículas de carvã suspensam no ar).
COEFICIENTE DE SOLUBILIDADE
Quando adicionamos sal a um copo com água, dependendo da quantidade colocada neste copo, o sal se dissolverá ou não. O mesmo acontece quando colocamos muito açúcar no café preto. Nem todo o açúcar se dissolverá no café. A quantidade que não se dissolver ficará depositada no fundo.
O Coeficiente de Solubilidade é a quantidade necessária de uma substância para saturar uma quantidade padrão de solvente, em determinada temperatura e pressão.
Em outras palvras, a solubilidade é definida como a concentração de uma substância em solução, que está em equilíbrio com o soluto puro a uma dada temperatura.
Exemplos:
AgNO3 – 330g/100mL de H2O a 25°C
NaCl – 357g/L de H2O a 0°C
AgCl – 0,00035g/100mL de H2O a 25°C
Veja que o AgCl é muito insolúvel. Quando o coeficiente de solubilidade é quase nulo, a substância é insolúvel naquele solvente.
Quando dois líquidos não se misturam chamamos de líquidos imiscíveis (água e óleo, por exemplo). Quando dois líquidos se misturam em qualquer proporção, ou seja, o coeficeinte de solubilidade é infinito, os líquidos são miscíves (água e álcool, por exemplo).
Classificação das Soluções Quanto à Quantidade de Soluto
De acordo com a quantidade de soluto dissolvida na solução podemos classificá-las em: solução saturada, solução insaturada e solução supersaturada.
Solução Saturada – são aquelas que atingiram o coeficiente de solubilidade. Está no limite da saturação. Contém a máxima quantidade de soluto dissolvido, está em equilíbrio com o soluto não-dissolvido, em determinada temperatura. Dizer que uma solução é saturada é o mesmo que dizer que a solução atingiu o ponto de saturação.
Soluto = Sovente
Solução Insaturada (Não-saturada) – são aquelas que contém menos soluto do que o estabelecido pelo coeficiente de solubilidade. Não está em equilíbrio, porque se for adicionado mais soluto, ele se dissolve até atingir a saturação.
Soluto < Solvente
Solução Supersaturada: são aquelas que contém mais soluto do que o necessário para formar uma solução saturada, em determinada temperatura. Ultrapassa o coeficiente de solubilidade. São instáveis e podem precipitar, formando o chamado precipitado (ppt) ou corpo de chão.
Soluto > Solvente
CURVAS DE SOLUBILIDADE
São gráficos que apresentam variação dos coeficientes de solubilidade das substâncias em função da temperatura.

1) Quem é mais solúvel B ou C ? Resposta: B
2) Quem é mais solúvel A ou B ? Resposta: Dependerá da temperatura, até 40 º C A é mais solúvel. A uma temperatura de 40ºC solubilidade é a mesma. Entretanto acima de 40ºC B é mais solúvel.


Através do gráfico também é possível observar que a solubilidade aumenta com o aumento da tempratura. Em geral, isso ocorre porque quando o soluto se dissolve com absorção de calor (dissolução endotérmica). As substâncias que se dissolvem com liberação de calor (dissolução exotérmica) tendem a ser menos solúveis a quente.


Observando o gráfico acima sobre a solubilidade de alguns sais, responda:
1) Qual o soluto mais solúvel a 0°C?
É o KI, porque solubiliza quase 130g em 100g de água.
2) Qual o C.S. aproximado do NaNO3 a 20°C?
90
3) Se a temperatura de uma solução baixar de 70°C para 50°C, qual será aproximadamente a massa do KBr que precipitará?
70°C = 90g
50°C = 80g
Então: 90-80 = 10g
4) Qual sal tem a solubilidade prejudicada pelo aquecimento?
Na2SO4
5) Se o KNO3 solubiliza 90g em 100g de água a 50°C, quanto solubilizará quando houver 50g de água?
![]()
x = 45g de sal KNO3
6) Que tipo de solução formaria 80g do sal NH4Cl a 20°C?
Solução Supersaturada.
