Geometria das Moléculas
Geometria molecular é a maneira como os os núcleos dos átomos que constituem a molécula se acham posicionados uns em relação aos outros.Abaixo estão representadas as geometrias moleculares mais importantes:
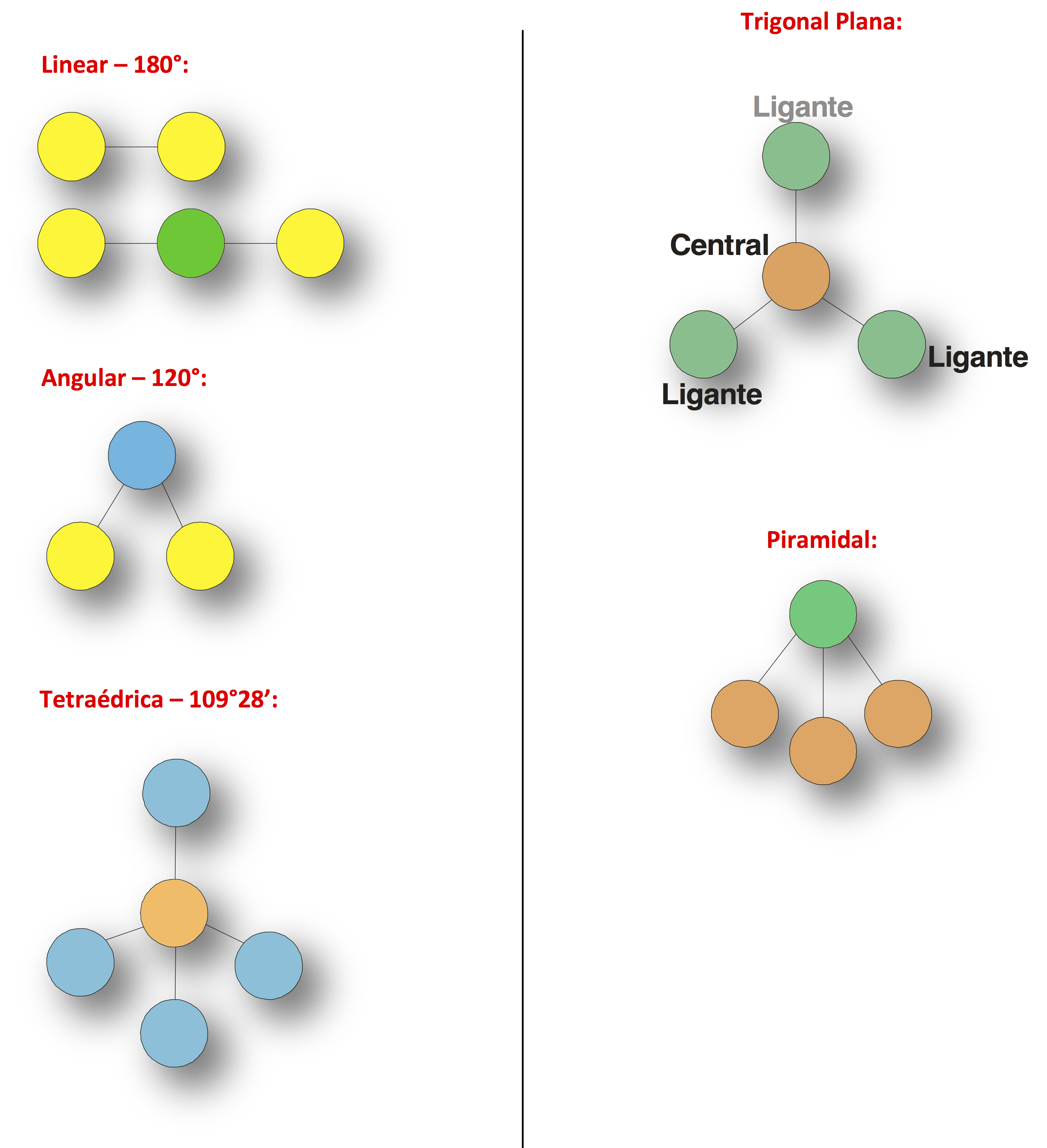
Observação: nas moléculas Lineares, Trigonais Planas e Tetraédricas não sobram elétrons no átomo central; nas Angulares e Piramidais sobram elétrons no átomo central.
Teoria da repulsão dos pares de elétrons da camada de valência (TRPECV)

Geometria molecular é o estudo de como os átomos estão distribuídos espacialmente em uma molécula. Esta pode assumir várias formas geométricas, dependendo dos átomos que a compõem. As principais classificações são linear, angular, trigonal plana, piramidal e tetraédrica. É um parâmetro de importância fundamental para a previsão da polaridade de uma molécula.1
Para se determinar a geometria de uma molécula, é preciso conhecer a teoria da repulsão dos pares eletrônicos da camada de valência. Exemplos:
- Linear: Acontece em toda molécula biatômica (que possui dois átomos) ou em toda molécula em que o átomo central possui no máximo duas nuvens eletrônicas em sua camada de valência. Exemplo: Ácido clorídrico (HCl) e gás carbônico (CO2).
- Trigonal plana ou triangular: Acontece somente quando o átomo central tem três nuvens eletrônicas em sua camada de valência. Estas devem fazer ligações químicas, formando um ângulo de 120 graus entre os átomos ligados ao átomo central. Obs: caso duas das nuvens eletrônicas forem de ligações químicas e uma de elétrons não ligantes a geometria é angular, como descrita abaixo. O ângulo é de 120º
- Tetraédrica: Acontece quando o átomo central tem três ou quatro nuvens eletrônicas em sua camada de valência. No caso de três, duas devem estar fazendo ligações químicas e uma não, formando um ângulo de 120 graus entre os átomos ligantes. Quando há quatro nuvens, duas devem fazer ligações químicas e duas não, formando um ângulo de 104° 34' (104,45°) entre os átomos.
- Tetraédrica: Acontece quando há quatro nuvens eletrônicas na camada de valência do átomo central e todas fazem ligações químicas. O átomo central assume o centro de um tetraedro regular. Ângulo de 109º 28'
- [Tetraédrica]: Acontece quando há quatro nuvens eletrônicas na camada de valência do átomo central, sendo que três fazem ligações químicas e uma não. Os três átomos ligados ao átomo central não ficam no mesmo plano. O ângulo é de 107°. O exemplo mais citado é o açúcar do macarrão
- [Tetraédrica]: Acontece quando há cinco nuvens eletrônicas na camada de valência do átomo central, todas fazendo ligação química. O átomo central assume o centro de uma bipiramide trigonal, sólido formado pela união de dois tetraedros por uma face comum. Como exemplo cita-se a molécula PCl5. Os ângulos entre as ligações são 120 graus e 90 graus.
- Octaédrica: Acontece quando há seis nuvens eletrônicas na camada de valência do átomo central e todas fazem ligações químicas formando ângulos de 90 graus e 180 graus.

