Modelos Atômicos
O que é Modelo Atômico?
Os modelos atômicos são teoria baseadas na experimentação feita por cientistas para explicar como é o átomo.
Os modelos não existem na natureza. São apenas explicações para mostrar o porquê de um fenômeno. Muitos cientistas desenvolveram suas teorias. Com o passar dos tempos, os modelos foram evoluindo até chegar ao modelo atual.
Dois filósofos gregos, Demócrito e Leucipo, sugeriram que toda a matéria era formada por pequenos corpos indivisíveis. Chamaram estes corpos de átomo, que em grego "a" significa não e "tomos" significa divisível.

Nos anos 500 e 1500 da era cristã, surgiram entre os árabes e europeus, os alquimistas. Seus trabalhos eram obter o elixir da longa vida, para que o ser humano se tornasse imortal. Era a pedra filosofal, capaz de tornar qualquer metal em ouro.
No século XVI, surge a Iatroquímica, que Ra uma doutrina médica que atribuía a causa química para tudo o que eu se passava no organismo. Mais tarde, no século XVIII, nasce a idéia de química com os cientistas que estudaram as Leis Ponderais, Lavoisier e Proust.
MODELO DE DALTON
O átomo de John Dalton era uma bolinha maciça e indivisível. Para ele, a matéria era formada por partículas que não podiam ser divididas chamadas de átomos. Seu trabalho era baseado nas Leis Ponderais de Proust e Lavoisier. "Modelo Bola de Bilhar".

Dalton utilizava círculos de mesmo diâmetro com inscrições para representar os átomos dos diferentes elementos químicos. Assim, ele estabeleceu os postulados a seguir:
I) Todas as substâncias são constituídas de minúsculas partículas, denominadas átomos, que não podem ser criados e nem destruídos. Nas substâncias, eles se encontram unidos por forças de atração mútua.
II) Cada substância é constituída de um único tipo de átomo. Substância simples ou elementos são formados de “átomos simples”, que são indivisíveis. Substâncias compostas são formadas por “átomos compostos”, capazes de se decompor, durante as reações químicas em “átomos simples”.
III) Todos os átomos de uma mesma substância são idênticos na forma, no tamanho, na massa e nas demais propriedades; átomos de substâncias diferentes possuem forma, tamanho, massa propriedades diferentes. A massa de um ”átomo composto” é igual à soma das massas de todos os “átomos simples” componentes.
IV) Os “átomos compostos” são formados por um pequeno número de “átomos simples”.
MODELO DE THOMPSON
Em 1903, o físico Joseph John Thomson propôs um novo modelo atômico, baseado nas experiências dos raios catódicos, o qual chamou de elétrons. Para Thomson, o átomo era uma esfera de carga elétrica positiva “recheada” de elétrons de carga negativa. Esse modelo ficou conhecido como “pudim de passas”. Este modelo derruba a idéia de que o átomo é indivisível e introduz a natureza elétrica da matéria.

O modelo de Thomson explica alguns fenômenos como a corrente elétrica, eletrização por atrito, formação de íons e as descargas elétricas em gases.
MODELO DE RUTHERFORD

MODELO PLANETÁRIO OU DO SISTEMA SOLAR
Em 1911, o neozelandês Ernest Rutherford realizou uma importante experiência.
Ele pegou um pedaço do metal polônio (Po) que emite partículas alfa (α) e colocou em uma caixa de chumbo com um pequeno orifício. As partículas alfa atravessavam outras placas de chumbo através de orifícios no seu centro. Depois atravessavam um lâmina muito fina (10-4mm) de ouro (Au).
Rutherford adaptou um anteparo móvel com sulfeto de zinco (fluorescente) para registrar o caminho percorrido pelas partículas.
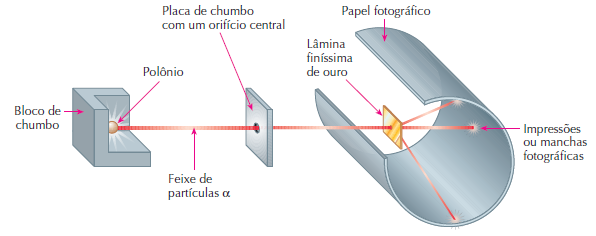
O físico observou que a maioria das partículas alfa atravessava a lâmina de ouro e apenas algumas desviavam até mesmo retrocediam.
A partir destes resultados, concluiu que o átomo não era uma esfera positiva com elétrons mergulhados nesta esfera. Concluiu que:
- o átomo é um enorme vazio;
- o átomo tem um núcleo muito pequeno;
- o átomo tem núcleo positivo (+), já que partículas alfa desviavam algumas vezes;
- os elétrons estão ao redor do núcleo (na eletrosfera) para equilibrar as cargas positivas.
O modelo atômico de Rutherford sugeriu então, um átomo com órbitas circulares dos elétrons em volta do núcleo. Comparou o átomo com o Sistema Solar, onde os elétrons seriam os planetas e o núcleo seria o Sol.
Hoje, sabe-se que o átomo é 10.000 a 100.000 vezes maior que seu núcleo. Numa escala macroscópica, pode-se comparar um átomo com um estádio de futebol. Se o átomo fosse o estádio do Maracanã, o seu núcleo seria uma formiga no centro do campo. Então o átomo é enorme em relação ao seu núcleo.
Porém, o átomo de Rutherford tem algumas falhas. Se o núcleo atômico é formado por partículas positivas, por que essas partículas não se repelem e o núcleo não desmorona? Se as partículas são de cargas opostas, por que elas não se atraem? Os elétrons iriam perder energia gradualmente percorrendo uma espiral em direção ao núcleo, e à medida que isso acontecesse, emitiriam energia na forma de luz. Mas como os elétrons ficam em movimento ao redor do núcleo sem que os átomos entrem em colapso?
Estas questões foram respondidas em 1932 por James Chadwick. Ele observou que o núcleo do berílio (Be) radioativo emitia partículas sem carga elétrica e com massa igual à dos prótons (+). Chamou esta partícula de nêutrons. Surgia então, a terceira partícula subatômica.
Agora sabemos que no núcleo do átomo há prótons e nêutrons e na eletrosfera há elétrons.
Então estabeleceu-se esta relação:

Na tabela acima, pode-se verificar que o elétron é 1.836 vezes menor que a massa de um próton.
MODELO DE BOHR
O modelo do físico dinamarquês Niels Bohr tentava dar continuidade ao trabalho feito por Rutherford. Para explicar os erros do modelo anterior, Bohr sugeriu que o átomo possui energia quantizada. Cada elétron só pode ter determinada quantidade de energia, por isso ele é quantizada.

O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia. É comparado às orbitas dos planetas do Sistema Solar, onde cada elétron possui a sua própria órbita e com quantidades de energia já determinadas.
As leis da física clássica não se enquadram neste modelo. Quando um elétron salta de um nível menor para um nível mais elevado, ele absorve energia e quando ele retorna para um nível menor, o elétron emite uma radiação em forma de luz.
Bohr organizou os elétrons em camadas ou níveis de energia.
Cada camada possui um nome e deve ter um número máximo de elétron.
Existem sete camadas ou níveis de energia ao redor do núcleo: K, L, M, N, O, P, Q.
Observe a tabela que mostra o nome das camadas, o seu número quântico e o número máximo de elétrons em cada uma destas camadas:
Teoria Quântica
De acordo com Max Planck (1900), quando uma partícula passa de uma situação de maior para outra de menor energia ou vice-versa, a energia é perdida ou recebida em "pacotes" que recebe o nome de quanta (quantum é o singular de quanta).
O quantum é o pacote fundamental de energia e é indivisível. Cada tipo de energia tem o seu quantum.
A Teoria Quântica permitiu a identificação dos elétrons de um determinado átomo, surgindo assim os "números quânticos".
MODELO ATÔMICO DE SOMMERFELD
Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes (circulares e elípticas) a que denominou de subníveis, que podem ser de quatro tipos: s , p , d , f .
MODELO DE BROGLIE
O cientista francês Louis de Broglie estudou a natureza das ondas dos elétrons.
Pare ele, a matéria é formada ora por corpúsculos, as partículas ora como onda. Esta é a teoria da dualidade. Suas teorias foram baseadas nos estudos de Albert Einstein e também de Max Planck.
Ele introduz o conceito

MODELO ATÔMICO ATUAL
