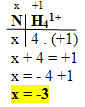Número de Oxidação
O número de oxidação (Nox) de um elemento é a carga elétrica que ele adquire quando faz uma ligação iônica ou o caráter parcial (δ) que ele adquire quando faz uma ligação predominantemente covalente.
Isso significa que corresponde à tendência de um átomo de atrair os elétrons envolvidos nas ligações que realiza. Por isso, a maioria dos elementos químicos apresenta diversos números de oxidação, dependendo do composto que ele está formando.
No entanto, existem alguns elementos, que normalmente são os mais eletropositivos ou mais eletronegativos, que apresentam o mesmo Nox em uma série de compostos diferentes. Esses elementos estão alistados na tabela abaixo:
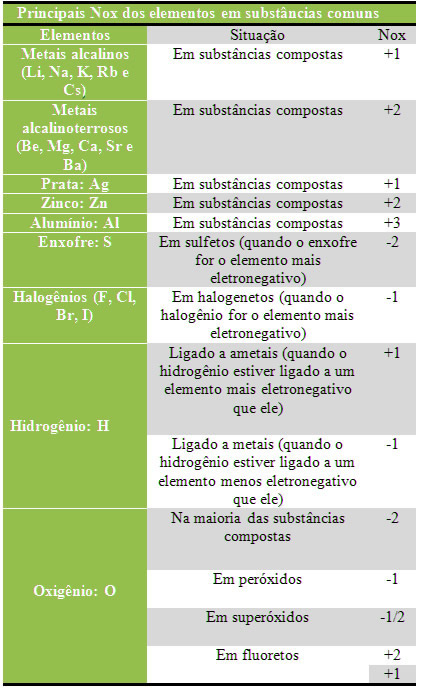
Com base nesses valores e nas regras a seguir é possível determinar qual será o Nox dos outros elementos presentes em diferentes substâncias:
- O Nox de substâncias simples é sempre igual a zero. Exemplos: N2, O2, H2, Na, Fe, Al.
- O Nox de íons é igual a sua carga. Exemplos:
Na1+: Nox = +1
O2-: Nox = -2
F1-: Nox = -1
- A soma dos Nox dos elementos de um composto sempre dá igual a zero;
- A soma dos Nox dos elementos em um íon composto é sempre igual à carga do íon.
Veja como usar essas informações para calcular o Nox de vários elementos:
1. H2SO4:
- O Nox do H é igual a +1;
- O Nox do O é igual a -2;
- A soma dos Nox desses compostos é igual a zero;
- Precisamos saber apenas o Nox do enxofre (S), que chamaremos de x:
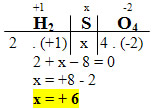
2. Na4P2O7:
- O Na é um metal alcalino, então seu Nox é igual a +1;
- O Nox do O é igual a -2;
- A soma dos Nox desses compostos é igual a zero;
- Precisamos saber apenas o Nox do fósforo (P), que chamaremos de x. Não se esquecendo de multiplicar pelo índice 2:
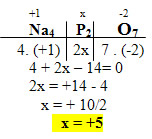
3. NH41+:
- Nesse caso temos um íon composto, então a soma dos Nox será igual à carga, que é +1: