Estrutura do Átomo
Átomo: Partícula elétricamente neutra formada por: Prótons,Nêutrons e Elétrons.
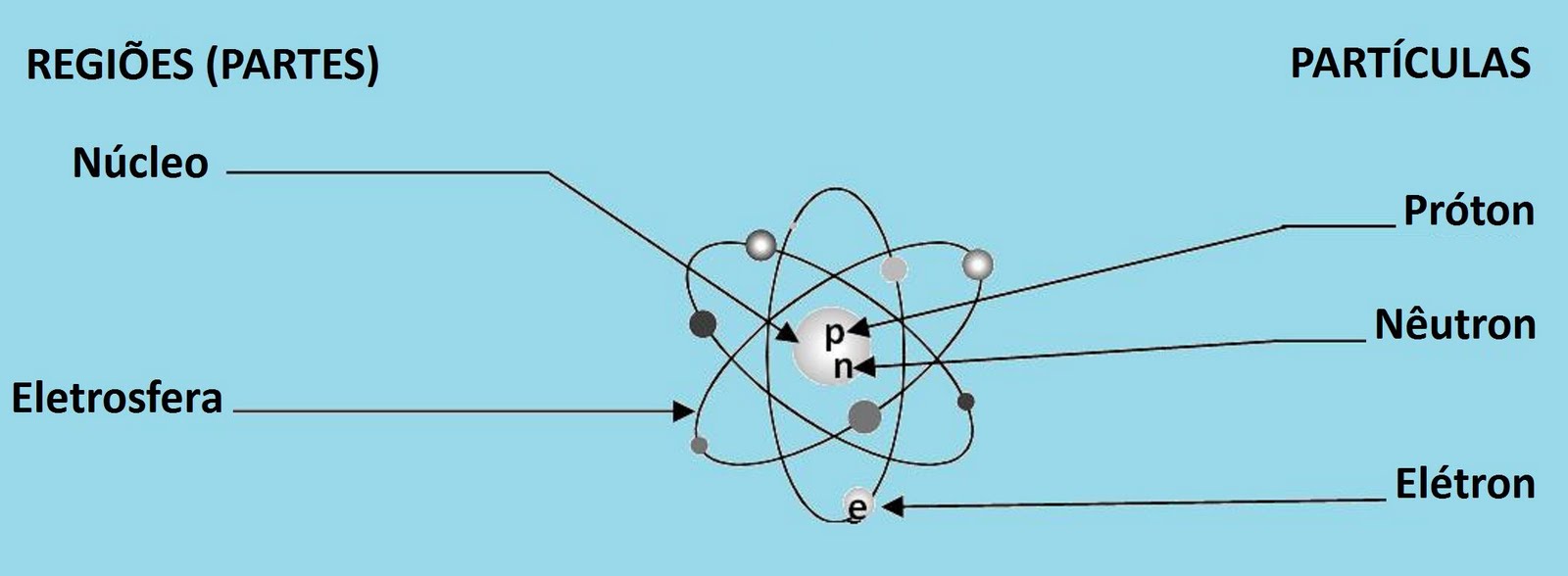
O interior do Átomo
No centro de um átomo está o seu núcleo, que apesar de pequeno, contém quase toda a massa do átomo. Os prótons e os nêutrons são as partículas nele encontradas, cada um com uma massa atômica unitária.
O Número de prótons no núcleo estabelece o número atômico do elemento químico e, o número de prótons somado ao número de nêutrons é o número de massa atômica. Os elétrons ficam fora do núcleo e tem pequena massa.
Características do átomo
a) Número atômico (Z): n.° de prótons (P) no núcleo de um átomo.
O número atômico caracteriza um elemento químico.
b) Número de massa (A): O número de massa é a soma dos prótons (P) e nêutrons (N) do núcleo de um átomo.
A = P + N ou A = Z + N
Um átomo (X) será representado assim:
AzX ou zXA
Íons: Para um átomo ser eletricamente neutro ele precisa ter a mesma quantidade de prótons e elétrons, mas como nem sempre isso ocorre, surge então os compostos denominados de íons. Íons são átomos que perderam ou ganharam elétrons em razão de reações, eles se classificam em ânions e cátions:
Ânions: átomo que recebe elétrons e fica carregado negativamente. Exemplos: N-3, Cl-, F-1, O-2.
Cátions: átomo que perde elétrons e adquire carga positiva. Exemplos: Al+3, Na+, Mg+2.
Primeiro é preciso destacar que ÂNIONS possuem número de elétrons maior que o número de prótons, e CÁTIONS o contrário: o número de elétrons é menor que o número de prótons.
15P → 15P-3
Átomo neutro recebe 3 elétrons
Observe que o átomo de fósforo (P) possuía Z = 15 (número atômico), mas ele ganhou 3 elétrons e então passou a se apresentar como um Ânion.
12Mg → 12Mg2+
Átomo neutro perde 2 elétrons
O átomo de Magnésio (Mg) possuía Z = 12 (número atômico), como ele perdeu 2 elétrons passou a ser um cátion.
A espécie química Mg2+ é chamada cátion bivalente ou íon bivalente positivo. Outro exemplo deste tipo de nomenclatura é o F-, denominado de ânion monovalente ou íon monovalente negativo.
Vejamos como se classificam os átomos de acordo com este princípio:
ISÓBAROS: esses átomos possuem o mesmo número de massa (A), mas se diferem na numeração atômica (Z), os elementos Cálcio (Ca) e Argônio (Ar) são isóbaros.
18Ar40 20Ca40
Como os isóbaros acima não pertencem a elementos químicos iguais, suas propriedades químicas se diferenciam.
ISÓTONOS: átomos com número de nêutrons (n) iguais que se diferem pelo número atômico (Z) e de massa (A). Magnésio (Mg) e Silício (Si) são exemplos de Isótonos.
12Mg26 14Si28
P = 12 n = 14 P = 14 n = 14
Estes isótonos pertencem a diferentes elementos químicos, o que nos leva a concluir que possuem diferentes propriedades químicas e físicas.
ISÓTOPOS: átomos pertencentes a um mesmo elemento químico, portanto possuem números atômicos iguais. Os isótopos se diferenciam com relação ao número de massa, acompanhe os exemplos:
O elemento químico Magnésio (Mg) possui os seguintes isótopos:
12Mg24 (presente na natureza com a porcentagem de 78,9%)
12Mg25 (presente na natureza com a porcentagem de 10,0%)
12Mg26 (presente na natureza com a porcentagem de 11,1%)
Os isótopos de hidrogênio recebem nomenclatura própria, veja:
1H1 – Hidrogênio comum, prótio, hidrogênio leve;
1H2 – Deutério;
1H3 – Trítio, tritério, tricério.
O hidrogênio comum é o que encontramos em maior quantidade na natureza, está presente na proporção de 99,9% em relação a seus isótopos.
IsótoNos: mesmo número de nêutrons.
IsótoPos: mesmo número de prótons.
IsóbAros: mesmo número de massa.
